化学は私たちの日常生活のあらゆる側面に影響を及ぼしています。料理、掃除、ガーデニング、さらには私たちの身体の働きまで、化学の理解はその理由やプロセスを理解するのに必要となります。また、化学の理解はさまざまな産業で重要です。製薬業界では、新しい薬物の開発や既存の薬物の改良、化学工業では、新しい素材や化合物を作るため、農業では、肥料や農薬の効果的な使用方法を理解するのに役立ち、エネルギー産業では、化石燃料の燃焼や再生可能エネルギー源の開発など幅広くかかわっています。
今回は基本に立ち返って化学の基礎知識を学習していこうと思います。
物質は最小単位として原子を持っています。それぞれの原子を詳細に調べることで、水素やヘリウムといった様々な元素が存在することが明らかになりました。
それぞれの元素は特有の原子から成り立っています。原子は中心にある原子核(陽子と中性子から成る)と、電子で構成されています。電子は特定のエネルギーレベルまたは電子殻に確率的に存在し、それが電子雲を形成します。原子核から離れるにつれて、電子殻はK殻、L殻、M殻などと名付けられて広がっています。それぞれの主殻はさらに副殻と呼ばれる部分に分けられ、これらはs、p、dといった軌道として知られています。
電子配置(electron configuration)は特定の規則に従って決まります。主要な規則としては、パウリの排他原則とフントの規則があります。
パウリの排他原則「電子はエネルギーの低い軌道から順に入る」
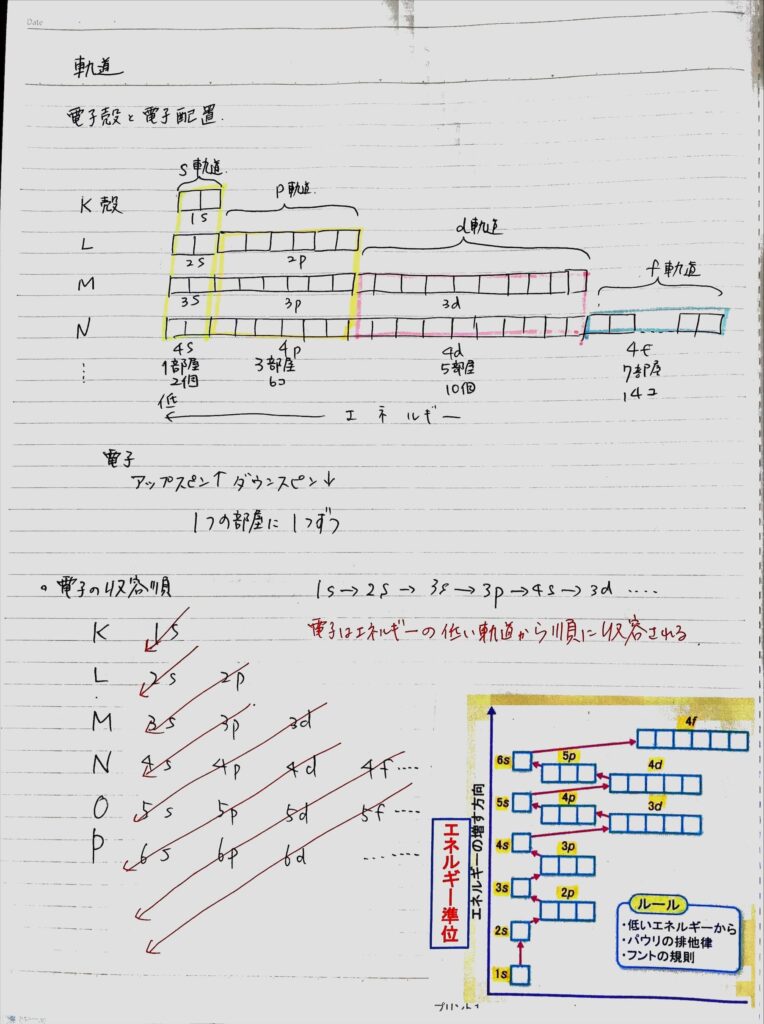
フントの規則は
①1つの軌道に最大2個の電子
②1つの軌道に2個の電子が入るときスピンは互いに逆

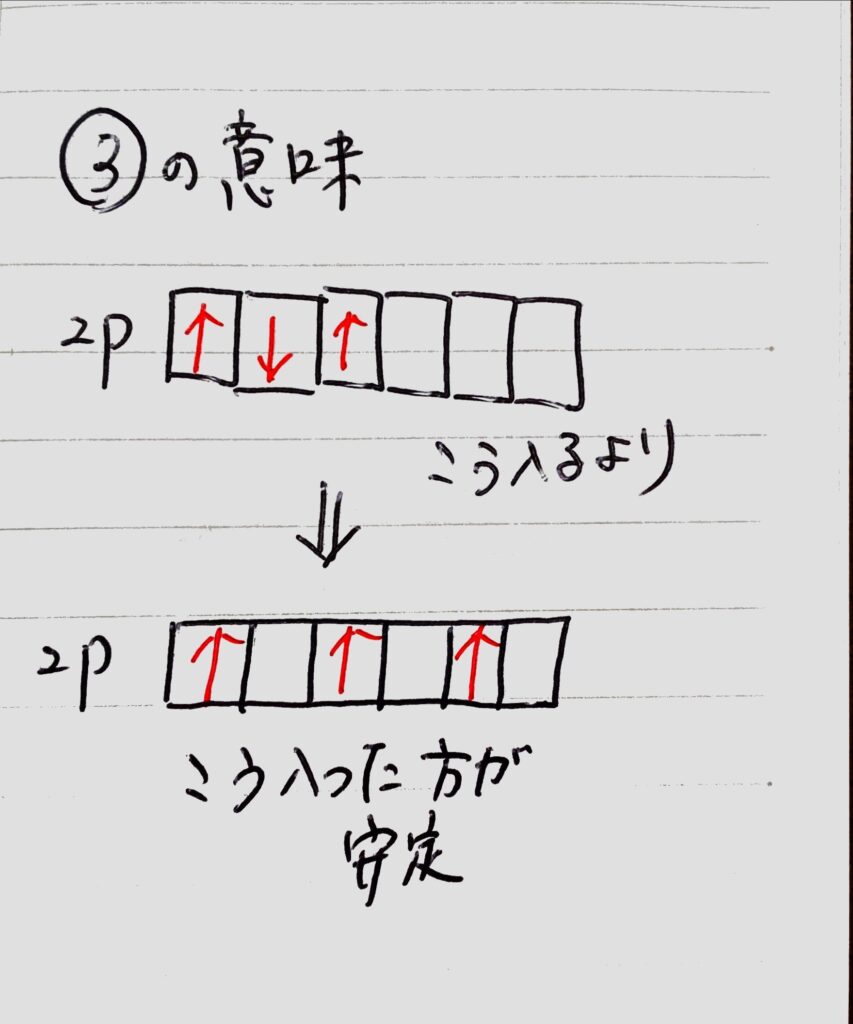
③エネルギーの等しい軌道(縮重した軌道)に1つずつ入るときはスピンの方向が同じほうが安定する
C(炭素 電子数6)を見てみましょう。
電子配置は以下のようになります。
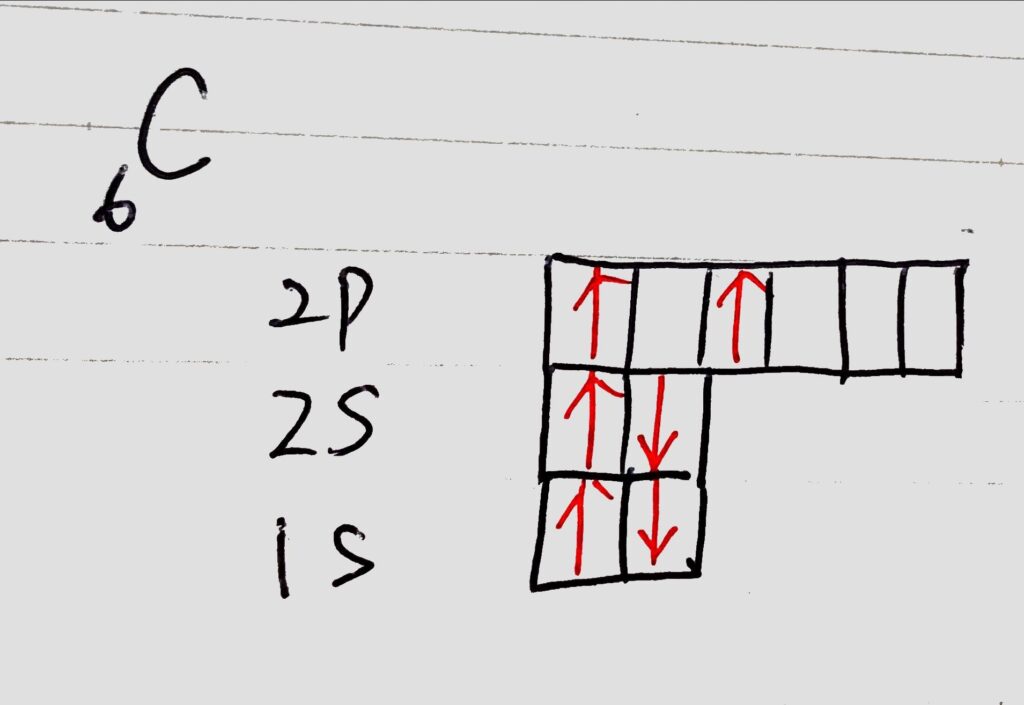
以上は、原子において最も安定な電子配置(基底状態ground state)の状態です。
では原子が結合などの反応を起こすときはどのようになるでしょうか。
エネルギーがかかり励起状態(excited state)となります。励起状態とは、外からのエネルギーを得ることにより、電子が遷移することです。
例としてCH4(メタン)を取り上げます。

電子配置を知ることにより、安定した基底状態とエネルギーを得た励起状態、さらにそのことによる軌道の混成について深めることができました。
これらの知識は、化学、物理学、材料科学、薬学、エネルギー科学、ナノテクノロジーなど、多くの産業分野で必要とされます。新しい材料の開発、新しいエネルギー源の開発、薬物の設計、環境問題の解決など、電子配置の理解は非常に重要です。



コメント